Mélatonine
De Mi caja de notas
Révision datée du 19 novembre 2019 à 17:13 par Xtof (discussion | contributions) (Page créée avec « {{wp}} »)
Cet article est une débauche. Vous pouvez m’aider à l'améliorer.
Mélatonine 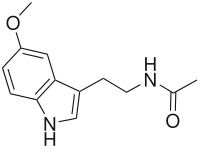

Structure de la mélatonine. Identification Nom UICPA N-[2-(5-méthoxy-1H-indol-3-yl)éthyl]
éthanamideSynonymes N-acétyl-5-méthoxytryptamine ou hormone du sommeil
No CAS No ECHA 100.000.725 No CE 200-797-7 Code ATC N05 DrugBank APRD00742 PubChem SMILES InChI Propriétés chimiques Formule C13H16N2O2 [Isomères]
Masse molaire[1] 232,278 3 ± 0,012 5 g/mol
C 67,22 %, H 6,94 %, N 12,06 %, O 13,78 %,Propriétés biochimiques Codons UGG Données pharmacocinétiques Biodisponibilité 30 – 50 % Métabolisme hépatique via CYP1A2 mediated 6-hydroxylation Demi-vie d’élim. 35 à 50 minutes Excrétion Unités du SI et CNTP, sauf indication contraire. modifier La mélatonine ou N-acétyl-5-méthoxytryptamine, souvent dénommée hormone du sommeil, est la molécule principale de la glande pinéale surtout connue comme étant l'hormone centrale de régulation des rythmes chronobiologiques en étant synthétisée surtout la nuit[2]. Elle régule de nombreuses sécrétions hormonales, chez l'humain et les autres mammifères[3],[4],[5]. Cette neurohormone est synthétisée à partir d'un neurotransmetteur, la sérotonine, qui dérive elle-même du tryptophane[6]. Elle est sécrétée par la glande pinéale (dans le cerveau) en réponse à l'absence de lumière[6].
La mélatonine semble avoir de multiples fonctions autres qu'hormonales, en particulier comme antioxydant[7]. Elle jouerait un rôle particulier dans la protection de l'ADN nucléaire et dans l'ADN mitochondrial[8]. Elle semble aussi jouer un rôle dans le système immunitaire[9].
En novembre 2020, deux études préliminaires révèlent une corrélation entre la prise de mélatonine et un risque réduit de la Covid-19[10],[11]. Toutefois, l'ANSES recommande à certaines catégories de la population de limiter sa consommation sous forme de complément alimentaire et d'en informer son médecin[12].
Des micro-organismes et diverses plantes produisent aussi de la mélatonine (dite phytomélatonine dans le cas des plantes)[13],[14],[15],[16],[17].
Synthèse
Synthèse diurne constitutive de la sérotonine
La sérotonine est synthétisée de façon constitutive le jour et la nuit mais la concentration de la sérotonine dans la glande pinéale est plus faible la nuit quand elle sert de substrat à la synthèse de mélatonine[18],[19]. Elle provient de la transformation du tryptophane faisant intervenir deux enzymes[6]. Tout d'abord, le tryptophane est transformé en 5-hydroxytryptophane par l'enzyme tryptophane hydroxylase (TH)[6]. Le 5-hydroxytryptophane subit ensuite une autre modification par l'enzyme aminoacide aromatique décarboxylase (AA-DC) pour donner la sérotonine[6]. La sérotonine est stockée dans la glande pinéale au fur et à mesure de sa synthèse[20]. La tryptophane hydroxylase est l'enzyme limitante de la production de sérotonine[21].
Synthèse nocturne régulée
Dans l'obscurité, la sérotonine est sécrétée et l'enzyme appelée sérotonine N-acétyltransférase (AA-NAT) catalyse une réaction de N-acétylation et permet la production de N-acétylsérotonine (ou N-acétyl-5 hydroxytryptamine). Ce composé est ensuite transformé en mélatonine (ou N-acétyl-5 méthoxytryptamine) grâce à l'enzyme acétylsérotonine O-méthyltransférase (ASMT)[22].
On obtient donc le bilan suivant :
Première étape (passage de l'AANAT) :
Sérotonine (C10H12N2O) + acétyl-CoA (C23H38N7O17P3S) → N-acétylsérotonine (C12H14N2O2) + coenzyme A (C21H36N7O16P3S)
Seconde étape (passage de l'ASMT) :
N-acétylsérotonine (C12H14N2O2) + S-adénosylméthionine (C15H22N6O5S) → mélatonine (C13H16N2O2)+ S-adénosylhomocystéine (C14H20N6O5S)
Régulation par l'AA-NAT
Chez les rongeurs, l'adrénaline nocturne, par augmentation d'AMPc, active la transcription de l'AA-NAT puis l'inhibe par accumulation graduelle d'ICER (Induced cAMP Element Response), maximum en fin de nuit.
Chez les ongulés et les primates, l'adrénaline nocturne, par augmentation d'AMPc, inhibe la protéolyse de l'AA-NAT synthétisée de façon constitutive[23].
Lieux de synthèse
La mélatonine est synthétisée, dans la glande pinéale et par la rétine[24] mais aussi par les cellules (dans les mitochondries[25],[26]) de la moelle osseuse, les lymphocytes, la peau, le tractus gastro-intestinal, les testicules, les ovaires, les astrocytes[27] ; et d'autres[28]. Normalement, la concentration de mélatonine dans ces cellules est plus grande que celle trouvée dans le sang, mais elle ne semble pas être régulée par la photopériode[23].
Apports alimentaires
Les noix et les noisettes sont des sources importantes de mélatonine biodisponible, c'est-à-dire facilement absorbable par l'organisme[29]. La mélatonine est également présente chez une grande variété d'autres végétaux comestibles (maïs, tomates, pommes de terre, oignon, ail, ananas, banane, riz, avoine, orge, gingembre, taro, etc.) mais généralement en quantités nettement inférieures. Par ailleurs, la teneur en mélatonine de certains aliments serait encore très mal connue[30].
La consommation de noix entraîne une multiplication par trois des taux sanguins de mélatonine chez les rats[29].
Physiologie
Elle régule la sécrétion de la plupart des hormones humaines (paracrines et endocrines). La mélatonine agit différemment selon son origine :
- celle produite dans la glande pinéale et dans le tractus gastro-intestinal[31],[32] agit comme une hormone endocrine car elle se diffuse dans le sang ;
- celle produite par la rétine agit comme une hormone paracrine[33].
Horloge biologique
Julius Axelrod, à partir de nombreuses expériences, découvre le rôle de la mélatonine et de la glande pinéale sur le cycle du sommeil et les autres rythmes circadiens. En temps normal, la mélatonine est sécrétée la nuit seulement (avec un pic de sécrétion à 5 heures du matin chez l'humain, et en moyenne, car sa production est inhibée par la lumière). Elle gère (en partie) les rythmes circadiens. Les variations quotidiennes du taux de mélatonine de l'organisme ne sont pas qu'une réponse passive aux variations de luminosité du monde environnant : il est également couplé à un ou plusieurs stimulateurs endogènes (horloge circadienne). Chez les mammifères le principal stimulateur circadien est situé dans les noyaux suprachiasmatiques (NSC) du cerveau, un ensemble bilatéral de neurones situé dans l'hypothalamus antérieur[34].
De nombreux animaux utilisent la variation de la durée de la production de la mélatonine comme repère biologique de la saison. Chez des animaux comme l'homme, le profil de la mélatonine est affecté par la différence de la longueur de la nuit de l'été par rapport à l'hiver. Ce changement de durée de sécrétion sert ainsi de signal biologique pour l'organisation des fonctions saisonnales dépendantes de la durée du jour (photopériodiques) comme la reproduction, certains comportements, la croissance du pelage, le camouflage par la couleur du pelage chez les animaux dépendant des saisons. Cette hormone est sécrétée à la fois par les animaux diurnes et nocturnes.
Liens avec la glycémie
La glycémie dépendrait aussi de l'expression de quelques gènes dont celui codant un récepteur (MT2) de la mélatonine[35]. Ce récepteur MT2 est trouvé dans la rétine, dans le nerf optique, dans la région du diencéphale mais aussi dans les cellules du pancréas sécrétant l'insuline. La mélatonine régule la sécrétion de leptine la nuit et diminue ses concentrations[36].
Appétit
La mélatonine interviendrait aussi dans l'appétit (et peut-être dans certains cas d'obésité)[36]. Injectée à des rats, elle augmente leur prise de nourriture et leur poids[37]. Inversement, une nourriture grasse perturbe le sommeil de souris de laboratoire via une hormone adiponectine, et une perturbation du rythme circadien les fait grossir[38]. Par ailleurs, une mutation du gène codant le récepteur 2 (MT2) de la mélatonine est associée à une augmentation du risque d'obésité et au diabète de type 2, mais aussi aux troubles du sommeil[39],[40].
Antioxydant
Dans les cellules non tumorales, la mélatonine agit comme un antioxydant impliqué dans les systèmes de protection cellulaire des organismes[41],[42],[43] qui traverse facilement les parois cellulaires ou la barrière hémato-encéphalique. Elle détruit ou inhibe l'action de certains radicaux libres et éléments facteurs de stress oxydatif tels que le radical hydroxyle (HO•), le peroxyde d'hydrogène, le monoxyde d'azote, l'anion peroxynitrite, l'acide peroxynitreux (nitration d'un cycle aromatique très activé vis-à-vis de la substitution électrophile) et l'acide chlorhydrique[44]. Les produits de chacune de ces réactions ont été identifiés dans les systèmes chimiques purs et dans un cas au moins in vivo[45]. Les produits secondaires issus de l'interaction de la mélatonine avec le radical hydroxyle HO• (la 3-hydroxymélatonine) sont par exemple retrouvés dans l'urine des humains et des rats[46].
Paradoxalement, dans les cellules tumorales (in vitro sur des cellules humaines leucémiques), ce capteur de radicaux libres stimule au contraire, par des mécanismes encore mal compris (en 2011)[47], la production d'espèces réactives de l'oxygène (ERO, en anglais ROS) capables de leur faire subir l'apoptose alors que la mélatonine empêche l'apoptose dans les cellules saines[47]. De manière générale, elle semble jouer un rôle régulateur de l'apoptose[48]. Des observations de ce type ont aussi été faites pour le cancer du sein. (in vitro et in vivo)[49],[50].
La fonction antioxydante de la mélatonine pourrait être apparue très tôt dans l'évolution[51]. Comme le composé bicyclique indole, qui représente le noyau de la molécule de mélatonine, est très riche en électrons[52], et qu'il est également substitué dans cette molécule par deux substituants (méthoxy- et une chaîne alkyle) fortement donneurs d'électrons qui renforcent encore cette richesse électronique, cette molécule possède de manière intrinsèque et perpétuelle la capacité d'attirer les structures pauvres en électrons (électrophiles ou oxydants, car ce qui les caractérise tous deux est leur déficience électronique) et de réagir avec elles selon le mécanisme de substitution électrophile aromatique. La mélatonine possède donc des propriétés antioxydantes de manière permanente[45].
En outre, la mélatonine augmente l'activité de plusieurs enzymes antioxydantes, ce qui améliore sa capacité de protection des macromolécules contre le stress oxydatif[53]. In vitro, dans des cellules de rats, elle diminue des dégâts induits par le peroxyde d'hydrogène, quand elle est en présence de ce dernier (même à faible dose), mais ne répare pas les cellules déjà endommagées[54].
L'expérimentation animale a montré que la mélatonine acquise via des aliments végétaux comestibles élève le taux d'indole dans le sang[55]. Le taux sanguin de mélatonine est corrélé avec l'activité antioxydante totale du sérum[56]. Contrairement aux autres antioxydants (comme la vitamine C), la mélatonine, une fois oxydée, ne peut pas être directement réduite pour retrouver son état initial, car la nitration d'un aromatique est une réaction irréversible.
Ces propriétés antioxydantes la font contribuer à certains processus de détoxification de l'organisme[57] ainsi qu'à certains processus de résistances aux stress oxydatifs, même chez des microorganismes[58].
Lors d'expériences faites par l'Institut de médecine militaire du ministère russe de la Défense sur des souris irradiées, la mélatonine s'est montrée moins protectrice que l'indraline[59] et la phényléphrine pour la peau, en usage topique, mais elle avait néanmoins des propriétés radioprotectrices (contre les effets d'une source radioactive externe ; en l'occurrence une source de Cobalt 60 émettant 38,3 Gy)[60].
L'administration de mélatonine chez le rat produirait un effet aussi anxiolytique qu'un médicament de référence, le diazépam, administré à la même dose (1 mg·kg-1)[61].
Système immunitaire
La mélatonine endogène produite par le système pinéal influe positivement sur le système immunitaire[62]. Elle peut également aider à la réponse immunitaire des lymphocytes T[63]. Son utilisation médicale pour augmenter la réponse est cependant soumise à controverse puisqu'elle favoriserait également les maladies auto-immunes[64]. La mélatonine peut supprimer la libido en inhibant la sécrétion de la LH (luteinizing hormone) et de FSH (follicle stimulating hormone) à partir de la glande antéhypophyse, notamment chez les mammifères qui ont une période d'allaitement quand la durée des jours est longue[6]. La reproduction des espèces qui allaitent quand le jour est long est diminuée par la mélatonine et stimulée quand le jour est court. La mélatonine augmenterait la libido (chez les rats mâles) par un antagonisme des récepteurs de la sérotonine de type 5-HT(2A)[65].
Réducteurs ou inhibiteurs de la sécrétion de mélatonine
Bêta-bloquants
Les bêta-bloquants abolissent la sécrétion nocturne de mélatonine. Ils causent également des insomnies. Une étude de 3 semaines sur des patients hypertensifs recevant ce traitement a montré que la mélatonine améliorait la qualité du sommeil et la durée de la phase 2 du sommeil (non-REM), sans affecter les autres phases. La durée de latence avant l'endormissement a également décru[66].
La caféine
La caféine associée à de la lumière réduit les niveaux de mélatonine[67].
Autres
L'exposition à la lumière artificielle la nuit réduit la sécrétion de mélatonine. La lumière dans le spectre du bleu émise par les LEDs et les écrans réduit significativement la sécrétion de mélatonine[68]. La lumière rouge semble avoir l'effet inverse[69],[70].
Autres
La mélatonine joue aussi un rôle dans la régulation de la pression artérielle[71], la protection des os[72],[73],[74].
Rôles proposés en pathologie
Maladie d'Alzheimer
Une étude clinique sur un échantillon pris au hasard (189 sujets, 90 % de femmes) publiée en 2008 montre que pour la maladie d'Alzheimer, la prise de mélatonine (de même que l'exposition à la lumière naturelle) améliore les symptômes de troubles des cycles du sommeil, en agissant comme inducteur de sommeil mais aussi comme facteur d'allongement de la durée de celui-ci[75].
L'exposition à la lumière naturelle diminuerait aussi chez ces malades :
- les symptômes de dépression (-19 %) ;
- les limitations fonctionnelles au quotidien (-53 %) ;
- la détérioration cognitive (-5 %).
La prise de mélatonine facilite l'endormissement (endormissement 8 minutes plus tôt en moyenne) et allonge le sommeil de 27 minutes en moyenne. L'association lumière + mélatonine a aussi diminué les comportements agressifs (-9 %), les phases d'agitation et de réveils nocturnes.
Le Dr Albert Lachman (spécialiste des troubles du sommeil) estime[76] qu'en améliorant le sommeil du malade on améliore aussi les fonctions cognitives et l'humeur. Il conseille « de bien éclairer les pièces en journée, de laisser les rideaux ouverts et, à l'inverse, de diminuer les sources de lumière en soirée pour que l'organisme reçoive le signal que la nuit est là ». « Malheureusement, dans certaines maisons de repos, pour des questions d'organisation, on fait plutôt l'inverse » ajoute-t-il[76].Dépression saisonnière
Dans les régions à hiver très gris comme l'Europe du Nord et le Canada, la baisse de luminosité hivernale (jours courts et gris) pourrait déclencher une surproduction de mélatonine engendrant chez un grand nombre de personnes une asthénie, voire une dépression saisonnière, qui disparaissent au printemps[77],[78].
Un nouvel antidépresseur (agomélatine[79]) cible les récepteurs à la mélatonine[80]. La mélatonine pourrait avoir des effets positifs sur certaines maladies psychiatriques[81],[82],[83].
Des séances de luminothérapie ne permettent pas de réguler la production de mélatonine mais augmente la sérotonine[84].
Syndrome prémenstruel
Une étude sur un petit groupe de femmes ayant un diagnostic de syndrome prémenstruel a montré que, lors de cette phase, les concentrations de mélatonine étaient significativement diminuées, ce qui pourrait expliquer les troubles du sommeil et la fatigue physique et psychique qui accompagne ce syndrome[85].
Sclérose latérale amyotrophique
Une étude chez la souris atteinte de sclérose latérale amyotrophique semble indiquer que la physiopathologie est associée avec un déficit en mélatonine ou son récepteur au niveau de la moelle épinière[86].
COVID-19
Sous réserve de confirmation par des essais contrôlés randomisés, des travaux américains récents (novembre 2020)[87],[88] font de la mélatonine un traitement théoriquement intéressant, complémentaire, contre le COVID-19 : après l'intubation elle améliore les chances de survie des patients Covid-19 (+ 13,1 %) et non Covid-19 (+ 27,8 %). Idem chez les malades du Covid-19 sous ventilation mécanique (+ 12,7 %) mais pas chez ceux qui sont ventilés mécaniquement pour d'autres raisons que la Covid-19. Son mécanisme d'action est mal compris.
C'est peut-être en réduisant le syndrome inflammatoire induit par le virus SARS-CoV-2 qu'elle agirait. Ce résultat est issu d'analyses de données faites par une plate-forme d'intelligence artificielle du Lerner Research Institute lié à la Cleveland Clinic (États-Unis) visant à identifier de possibles médicaments (existants) contre le coronavirus. En outre selon le registre Covid-19 de la Cleveland Clinic les patients qui avaient un traitement comprenant de la mélatonine avaient 30 % de risques en moins d'avoir un tests positifs au SARS-CoV-2 (après ajustement de certaines variables tels que l'âge, l'origine ethnique, le tabagisme et diverses comorbidités). Et chez les afro-américains, le risque diminuait de 52 % (après ajustement pour les mêmes variables)[89].Cancer
20 mg par jour de mélatonine diminue les effets secondaires de la radio-chimiothérapie d'au moins 60% et augmente la survie à un an d'au moins 30% dans une méta-analyse d'essais cliniques portant sur des cancers solides[90]. Des études préliminaires indiquent que des doses plus élevées, seules ou en association avec d'autres substances, semblent avoir des effets bénéfiques[91],[92],[93].
Migraine
La prise de 3 mg de mélatonine, à libération immédiate, le soir avant de se coucher, semble efficace[94].
Sepsis
L'administration intraveineuse de mélatonine améliorerait l'évolution de la maladie chez les patients chirurgicaux atteints de sepsis sévère[95].
Usage médical
L'augmentation de la sécrétion de mélatonine en fin de journée est impliquée dans le déclenchement du sommeil. Néanmoins, les doses sécrétées par l'organisme varient beaucoup selon les individus (certaines personnes n'en sécrétant que très peu)[78] et au cours de la vie en fonction de l'âge[96]. Elle est donc utilisée depuis quelques années, dans certains pays, pour soigner les troubles du sommeil (insomnies). La mélatonine est ainsi employée dans les insomnies en rapport avec le syndrome du décalage horaire lors des voyages transcontinentaux[97]. Dans les autres types d'insomnie (comme l'insomnie chez les personnes âgées), son efficacité n'est que modeste[98]. Contrairement aux benzodiazépines, la mélatonine ne provoquerait pas de dépendance.
Aux États-Unis, au Canada et au Mexique, par exemple, la mélatonine est en vente libre.
En Europe, la mélatonine a obtenu une autorisation de mise sur le marché (AMM) via la procédure centralisée[99] dosée à 2 mg.
En France, la mélatonine est en vente libre depuis février 2014 dans les pharmacies et dans les grandes surfaces, mais elle n'est pas remboursée par l'Assurance-maladie. Cette molécule est toutefois inscrite sur la liste I des substances vénéneuses depuis le [100], jusqu'en où son inscription passe à la liste II[101]. Malgré ces mesures législatives, elle se trouverait encore commercialisée hors officine en 2014[102]. Elle dispose, en France, d'une AMM depuis 2008 et est commercialisée sous le nom de Circadin, mélatonine à libération prolongée[103],[104],[105]. Elle est indiquée, en monothérapie, pour le traitement à court terme de l'insomnie primaire caractérisée par un sommeil de mauvaise qualité chez des patients de 55 ans ou plus[106]. Elle n'est pas remboursable dans les indications de l'AMM mais le médicament peut être pris en charge à titre dérogatoire par l'Assurance maladie dans la limite de 500 € par année civile et par patient dans l'indication : « traitement du trouble du rythme veille-sommeil, chez l'enfant de plus de 6 ans, associé à un syndrome de Rett ou à l'une des maladies neurogénétiques suivantes : syndrome de Smith-Magenis, syndrome d'Angelman, sclérose tubéreuse de Bourneville[103]. »
Les compléments alimentaires à base de mélatonine ne doivent pas dépasser 1,9 mg. En fait, une dose quotidienne de 0,3 mg (300 μg[107]) est suffisante pour recaler un rythme circadien déphasé[108]. Pourtant, certains produits en vente libre contiennent de 3 à 10 fois plus de cette hormone qu'il n'est nécessaire pour améliorer la qualité du sommeil[109]. Ces hautes doses peuvent même être contre-productives. Une étude montre que des doses élevées de mélatonine peuvent avoir des effets inappropriés (« too much melatonin may spill over onto the wrong zone of the melatonin phase-response curve »)[110] : dans cette étude, 0,5 mg de mélatonine a été efficace, mais pas 20 mg (40 fois plus).
Analogues pharmaceutiques de la mélatonine
Alors que la mélatonine n'est pas largement recommandée par les autorités médicales[111], le ramelteon[112] ((S)-N-(2-(1,6,7,8-tétrahydro-2H-indéno-(5,4)furan-8-yl)éthyl)propionamide), vendu sous le nom de Rozerem (propriété de Takeda Pharmaceuticals), ainsi que le tasimeltéon qui est conçu pour activer les récepteurs de la mélatonine MT1 et MT2, a été approuvé pour le traitement de l'insomnie aux États-Unis.
Divers analogues sont étudiés visant les récepteurs de la mélatonine, par exemple testés contre les effets de la tension intraoculaire (chez le lapin au début des années 2000)[113],[114],[115].
Depuis 2011, il est prouvé que les récepteurs MT1 et MT2 agissent de manières opposées, le MT1 agissant sur le sommeil paradoxal (REM) et le MT2 sur le sommeil non-paradoxal (non-REM). Le développement d'un ligand sélectif du récepteur MT2 permet d’isoler les effets réparateurs spécifiques de son activation[116].
Traitement des douleurs chroniques liées à l'endométriose
La mélatonine réduit les scores de douleur quotidiens avec une amélioration de la qualité du sommeil des femmes souffrant d'endométriose[117].
FIV et la Mélatonine
La mélatonine, principalement connue pour réguler le cycle veille-sommeil, joue également un rôle significatif dans la fertilité. Elle influence les hormones reproductives et se trouve dans le liquide folliculaire des ovaires, contribuant à la protection et au développement des ovocytes (cellules œufs). Ses propriétés antioxydantes sont essentielles pour réduire le stress oxydatif, qui peut affecter la fertilité chez les deux sexes.
Chez les femmes suivant des traitements de FIV (fécondation in vitro), la mélatonine est reconnue pour améliorer la qualité des ovocytes et a été associée à de meilleurs résultats. Chez les hommes, elle pourrait améliorer la qualité du sperme en atténuant les dommages oxydatifs. Cependant, il est important de noter que la supplémentation en mélatonine est généralement recommandée spécifiquement pour les traitements de FIV et non pour les grossesses régulières. L'utilisation de la mélatonine dans les grossesses habituelles manque de recherches suffisantes pour établir sa sécurité et son efficacité.
Usages en médecine vétérinaire
La plupart des animaux semblent produire de la mélatonine et/ou y être sensibles. La mélatonine est aussi un produit vétérinaire qui permet des gestations à toute période de l'année chez des mammifères d'élevage (chèvre…)[118]. Les poules exposées à la lumière pondent toute l'année, phénomène induit par l'éclairage forcé.
Rôles de la lumière et de l'obscurité
L'impact de l'éclairage artificiel sur l'humain est encore mal mesuré, mais les aveugles souffrent souvent de troubles du sommeil. La prise quotidienne de mélatonine une heure avant le coucher recalerait leur rythme circadien sur le cycle de vingt-quatre heures et donc améliorerait, voire préviendrait, les troubles du sommeil[119].
Effets indésirables
On a longtemps considéré que les effets indésirables de la mélatonine utilisée comme médicament ou en complément alimentaire (autorisée en France s'ils apportent moins de 2 mg/jour de mélatonine) étaient rares (excepté la somnolence, si prise à haute dose), car la mélatonine exogène n'était pas supposée affecter sa sécrétion endogène, à court ou moyen terme. Toutefois :
- la prise de mélatonine associée à un inhibiteur des monoamine oxydases (IMAO) peut provoquer un surdosage car les IMAO inhibent la métabolisation de la mélatonine par l'organisme ;
- en 2018, l'ANSES a recommandé à certaines populations de ne pas utiliser de compléments alimentaires contenant de la mélatonine ou de le faire après un avis médical[120]. Ceci fait suite à des effets indésirables signalés (en lien avec le programme français de nutrivigilance qui a reçu 90 cas d'effets indésirables avant 2018), qui évoquent des risques « en particulier des femmes enceintes et allaitantes, des enfants et des adolescents, des personnes souffrant de maladies inflammatoires, auto-immunes, d’épilepsie, d’asthme, de troubles de l’humeur, du comportement ou de la personnalité, ainsi que des personnes suivant un traitement médicamenteux[120]. La consommation est également déconseillée pour les personnes devant réaliser une activité nécessitant une vigilance soutenue chez lesquelles une somnolence pourrait poser un problème de sécurité »[120]. La mélatonine affecte l’horloge biologique mais aussi l'humeur, l'immunité, la température corporelle et la motricité intestinale et agit parfois comme vasodilatateur, vasoconstricteur et/ou comme pro-inflammatoire pouvant dans certains contextes ou en interagissant avec d’autres substances induire des effets indésirables généraux (« céphalées, vertiges, somnolence, cauchemars, irritabilité ») voire des troubles neurologiques (« tremblements, migraines ») et gastro-entériques (« nausées, vomissements, douleurs abdominales »)[120].
L'Agence recommande aux personnes en bonne santé de limiter ces compléments alimentaires et de les signaler à leur médecin[120].- D'après une méta-analyse récente, la mélatonine ne causerait pas spécialement d'effets indésirables graves[121].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Altun A, Ugur-Altun B, « Melatonin: therapeutic and clinical utilization », Int J Clin Pract, vol. 61, no 5, , p. 835–45 (PMID 17298593, DOI 10.1111/j.1742-1241.2006.01191.x).
- Alejandro Ibáñez-Costa, José Córdoba-Chacón, Manuel D. Gahete et Rhonda D. Kineman, « Melatonin regulates somatotrope and lactotrope function through common and distinct signaling pathways in cultured primary pituitary cells from female primates », Endocrinology, vol. 156, no 3, , p. 1100–1110 (ISSN 1945-7170, PMID 25545385, PMCID 4330310, DOI 10.1210/en.2014-1819, lire en ligne, consulté le )
- (en) José Cipolla-Neto et Fernanda Gaspar do Amaral, « Melatonin as a Hormone: New Physiological and Clinical Insights », Endocrine Reviews, vol. 39, no 6, , p. 990–1028 (ISSN 0163-769X et 1945-7189, DOI 10.1210/er.2018-00084, lire en ligne, consulté le )
- (en) José Cipolla-Neto, Fernanda Gaspar Amaral, José Maria Soares, Jr et Camila Congentino Gallo, « The Crosstalk between Melatonin and Sex Steroid Hormones », Neuroendocrinology, vol. 112, no 2, , p. 115–129 (ISSN 0028-3835 et 1423-0194, DOI 10.1159/000516148, lire en ligne, consulté le )
- Encyclopædia Universalis, « MÉLATONINE », sur Encyclopædia Universalis (consulté le )
- (en) Hardeland R, « Antioxidative protection by melatonin: multiplicity of mechanisms from radical detoxification to radical avoidance », Endocrine, vol. 27, no 2, , p. 119–30. (PMID 16217125, DOI 10.1385/ENDO:27:2:119)
- Reiter RJ, Acuña-Castroviejo D, Tan DX, Burkhardt S, « Free radical-mediated molecular damage. Mechanisms for the protective actions of melatonin in the central nervous system », Ann NY Acad Sci, vol. 939, , p. 200–15. (PMID 11462772, DOI 10.1111/j.1749-6632.2001.tb03627.x, Bibcode 2001NYASA.939..200R)
- Antonio Carrillo-Vico, Juan M. Guerrero, Patricia J. Lardone et Russel J. Reiter, « A review of the multiple actions of melatonin on the immune system », Endocrine, vol. 27, no 2, , p. 189–200 (ISSN 1355-008X, PMID 16217132, DOI 10.1385/ENDO:27:2:189, lire en ligne, consulté le )
- « La mélatonine a-t-elle un intérêt dans la prévention de la Covid-19 ? », sur Top Santé, (consulté le ).
- (en) Feixiong Cheng, « A network medicine approach to investigation and population-based validation of disease manifestations and drug repurposing for COVID-19 », PLOS Biology, vol. 18, no 11, , e3000970 (ISSN 1545-7885, DOI 10.1371/journal.pbio.3000970, lire en ligne, consulté le ).
- « L’Anses recommande à certaines populations d’éviter la consommation de compléments alimentaires contenant de la mélatonine », sur Anses - Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail, (consulté le )
- (en) Paredes SD, Korkmaz A, Manchester LC, Tan DX et RJ. Reiter, « Phytomelatonin: a review » Journal of Experimental Botany 2009;60(1):57–69.
- (en) REITER Russel J. ; DUN XIAN TAN ; BURKHARDT Susanne ; MANCHESTER Lucien C. ; Melatonin in plants, in Nutrition reviews ; 2001, Ed : International Life Sciences Institute ; vol. 59, no 9, p. 286-290 (47 ref.) ; ISSN 0029-6643 Fiche INIST CNRS.
- (en) Caniato R, Filippini R, Piovan A, Puricelli L, Borsarini A, Cappelletti E. « Melatonin in plants » Adv Exp Med Biol. 2003;527:593–7.
- (en) Caniato R, Filippini R, Piovan A, Puricelli L, Borsarini A, Cappelletti EM, « Melatonin in plants », Adv Exp Med. Biol., vol. 527, , p. 593–7. (ISBN 978-0-306-47755-3, PMID 15206778, DOI 10.1007/978-1-4615-0135-0_68)
- (en) Paredes SD, Korkmaz A, Manchester LC, Tan DX, Reiter RJ, « Phytomelatonin: a review », J Exp Bot, vol. 60, no 1, , p. 57–69 (PMID 19033551, DOI 10.1093/jxb/ern284)
- (en) Bo Hyun Lee, Bertil Hille et Duk-Su Koh, « Serotonin modulates melatonin synthesis as an autocrine neurotransmitter in the pineal gland », Proceedings of the National Academy of Sciences, vol. 118, no 43, , e2113852118 (ISSN 0027-8424 et 1091-6490, PMID 34675083, PMCID PMC8639368, DOI 10.1073/pnas.2113852118, lire en ligne, consulté le )
- A. Lerchl et S. Schlatt, « Serotonin content and melatonin production in the pineal gland of the male Djungarian hamster (Phodopus sungorus) », Journal of Pineal Research, vol. 12, no 3, , p. 128–134 (ISSN 0742-3098, PMID 1380550, DOI 10.1111/j.1600-079x.1992.tb00039.x, lire en ligne, consulté le )
- Jimo Borjigin, L. Samantha Zhang et Anda-Alexandra Calinescu, « Circadian Regulation of Pineal Gland Rhythmicity », Molecular and cellular endocrinology, vol. 349, no 1, , p. 13–19 (ISSN 0303-7207, PMID 21782887, PMCID 3202635, DOI 10.1016/j.mce.2011.07.009, lire en ligne, consulté le )
- (en) Donald M. Kuhn et Hiroyuki Hasegawa, « Tryptophan hydroxylase and serotonin synthesis regulation », dans Handbook of Behavioral Neuroscience, vol. 31, Elsevier, (ISBN 978-0-444-64125-0, DOI 10.1016/b978-0-444-64125-0.00012-8, lire en ligne), p. 239–256
- Tiecheng Liu et Jimo Borjigin, « N-acetyltransferase is not the rate-limiting enzyme of melatonin synthesis at night », Journal of Pineal Research, vol. 39, no 1, , p. 91–96 (ISSN 0742-3098, PMID 15978063, DOI 10.1111/j.1600-079X.2005.00223.x, lire en ligne, consulté le )
- (en) Carmen Venegas, José A. García, Germaine Escames et Francisco Ortiz, « Extrapineal melatonin: analysis of its subcellular distribution and daily fluctuations: Brain and liver extrapineal melatonin distribution », Journal of Pineal Research, vol. 52, no 2, , p. 217–227 (DOI 10.1111/j.1600-079X.2011.00931.x, lire en ligne, consulté le )
- Gianluca Tosini, Kenkichi Baba, Christopher K. Hwang et P. Michael Iuvone, « Melatonin: an underappreciated player in retinal physiology and pathophysiology », Experimental Eye Research, vol. 103, , p. 82–89 (ISSN 1096-0007, PMID 22960156, PMCID 3462291, DOI 10.1016/j.exer.2012.08.009, lire en ligne, consulté le )
- Yalikun Suofu, Wei Li, Frédéric G. Jean-Alphonse et Jiaoying Jia, « Dual role of mitochondria in producing melatonin and driving GPCR signaling to block cytochrome c release », Proceedings of the National Academy of Sciences of the United States of America, vol. 114, no 38, , E7997–E8006 (ISSN 0027-8424, PMID 28874589, PMCID 5617277, DOI 10.1073/pnas.1705768114, lire en ligne, consulté le )
- Russel J. Reiter, Dun Xian Tan, Sergio Rosales-Corral et Annia Galano, « Mitochondria: Central Organelles for Melatonin′s Antioxidant and Anti-Aging Actions », Molecules : A Journal of Synthetic Chemistry and Natural Product Chemistry, vol. 23, no 2, , p. 509 (ISSN 1420-3049, PMID 29495303, PMCID 6017324, DOI 10.3390/molecules23020509, lire en ligne, consulté le )
- A. Conti, S. Conconi, E. Hertens et K. Skwarlo-Sonta, « Evidence for melatonin synthesis in mouse and human bone marrow cells », Journal of Pineal Research, vol. 28, no 4, , p. 193–202 (ISSN 0742-3098, PMID 10831154, DOI 10.1034/j.1600-079x.2000.280401.x, lire en ligne, consulté le )
- (en) Dun Tan, Bing Xu, Xinjia Zhou et Russel Reiter, « Pineal Calcification, Melatonin Production, Aging, Associated Health Consequences and Rejuvenation of the Pineal Gland », Molecules, vol. 23, no 2, , p. 301 (ISSN 1420-3049, PMID 29385085, PMCID PMC6017004, DOI 10.3390/molecules23020301, lire en ligne, consulté le )
- (en) Reiter RJ, Manchester LC, Tan DX. Melatonin in walnuts : Influence on levels of melatonin and total antioxidant capacity of blood. Nutrition. 2005 Sep;21(9):920-4.
- (en) Paredes SD, Korkmaz A, Manchester LC, Tan DX, Reiter RJ, « Phytomelatonin : a review », J. Exp. Bot., vol. 60, no 1, , p. 57–69 (PMID 19033551, DOI 10.1093/jxb/ern284, lire en ligne).
- Garth R. Swanson, Annika Gorenz, Maliha Shaikh et Vishal Desai, « Decreased melatonin secretion is associated with increased intestinal permeability and marker of endotoxemia in alcoholics », American Journal of Physiology - Gastrointestinal and Liver Physiology, vol. 308, no 12, , G1004–G1011 (ISSN 0193-1857, PMID 25907689, PMCID 4469868, DOI 10.1152/ajpgi.00002.2015, lire en ligne, consulté le )
- Young Sook Park, Soo Hyung Kim, Jong Won Park et Younglim Kho, « Melatonin in the colon modulates intestinal microbiota in response to stress and sleep deprivation », Intestinal Research, vol. 18, no 3, , p. 325–336 (ISSN 1598-9100, PMID 32564539, PMCID 7385569, DOI 10.5217/ir.2019.00093, lire en ligne, consulté le )
- (en) Jianqiao Li, Jiongwan Hong, Fang Zhou et Shibo Tang, « Regulatory mechanism of melatonin on the retinal ganglion cell photoreaction in mice », Experimental and Therapeutic Medicine, vol. 14, no 2, , p. 1491–1495 (ISSN 1792-0981 et 1792-1015, PMID 28781626, PMCID PMC5526176, DOI 10.3892/etm.2017.4672, lire en ligne, consulté le )
- (en) Andries Kalsbeek et al. (2000), « Melatonin sees the light: blocking GABA-ergic transmission in the paraventricular nucleus induces daytime secretion of melatonin » European Journal of Neuroscience vol. 12, no 9, pages 3146–3154, septembre 2000 ; DOI 10.1046/j.1460-9568.2000.00202.x (résumé)
- Étude conduite par Philippe Froguel (laboratoire Génomique et physiologie moléculaire des maladies métaboliques ; CNRS/ Université Lille 2 Droit et Santé/ Institut Pasteur de Lille) et l'Imperial College London, en collaboration avec des équipes françaises, finlandaises et danoises, sur la base de l'analyse du génome de 23 000 personnes, publiée dans Nature Genetics en décembre 2008 (A variant near MTNR1B is associated with increased fasting plasma glucose levels and type 2 diabetes risks. N. Bouatia-Naji et al. ; Nature Genetics, numéro 41, pages 89–94, 2009, https://doi.org/10.1038/ng.277 ). Les résultats de cette étude ont été confirmés par deux autres études internationales publiées au même moment (CNRS).
- Vennila Suriagandhi et Vasanthi Nachiappan, « Protective Effects of Melatonin against Obesity-Induced by Leptin Resistance », Behavioural Brain Research, vol. 417, , p. 113598 (ISSN 1872-7549, PMID 34563600, DOI 10.1016/j.bbr.2021.113598, lire en ligne, consulté le )
- Article « Les clés du sommeil », Pour la Science, janvier 2004.
- Pilar Cano, Daniel P. Cardinali, María J. Ríos-Lugo et María P. Fernández-Mateos, « Effect of a high-fat diet on 24-hour pattern of circulating adipocytokines in rats », Obesity (Silver Spring, Md.), vol. 17, no 10, , p. 1866–1871 (ISSN 1930-7381, PMID 19543212, DOI 10.1038/oby.2009.200, lire en ligne, consulté le )
- Angeliki Karamitri, Nicolas Renault, Nathalie Clement et Jean-Luc Guillaume, « Minireview: Toward the establishment of a link between melatonin and glucose homeostasis: association of melatonin MT2 receptor variants with type 2 diabetes », Molecular Endocrinology (Baltimore, Md.), vol. 27, no 8, , p. 1217–1233 (ISSN 1944-9917, PMID 23798576, PMCID 5427945, DOI 10.1210/me.2013-1101, lire en ligne, consulté le )
- Alan Hegron et Ralf Jockers, « Analyse approfondie du lien entre le récepteur MT2 de la mélatonine et le diabète de type 2 », médecine/sciences, vol. 35, no 5, , p. 412–416 (ISSN 0767-0974 et 1958-5381, DOI 10.1051/medsci/2019088, lire en ligne, consulté le )
- (en) Tan D. X., Manchester L. C., Reiter R. J., Qui W. B. Karbownik M., Calvo J. R. (2000) Significance of melatonin in antioxidative defense system: reaction and products. Biol. Signal. Recept. 9: 137-159
- (en) Korkmaz A, Reiter RJ, Topal T, Manchester LC, Oter S, Tan DX, « Melatonin : an established antioxidant worthy of use in clinical trials », Mol. Med., vol. 15, nos 1-2, , p. 43–50 (PMID 19011689, PMCID 2582546, DOI 10.2119/molmed.2008.00117, lire en ligne).
- (en) Akcay YD, Yalcin A, Sozmen EY, « The effect of melatonin on lipid peroxidation and nitrite/nitrate levels, and on superoxide dismutase and catalase activities in kainic acid-induced injury », Cell. Mol. Biol. Lett., vol. 10, no 2, , p. 321–9 (PMID 16010296, lire en ligne [PDF]).
- (en) Poeggeler B, Saarela S and RJ. Reiter, 1994. Melatonin—a highly potent endogenous radical scavenger and electron donor: new aspects of the oxidation chemistry of this indole accessed in vitro. Ann. N. Y. Acad. Sci. 738: 419–20
- (en) Dun-Xian Tan, Lucien C. Manchester, Maria P. Terron et Luis J. Flores, « One molecule, many derivatives: A never-ending interaction of melatonin with reactive oxygen and nitrogen species? », Journal of Pineal Research, vol. 42, no 1, , p. 28–42 (ISSN 0742-3098 et 1600-079X, DOI 10.1111/j.1600-079X.2006.00407.x, lire en ligne, consulté le )
- Dun-Xian Tan, Lucien C. Manchester, Eduardo Esteban-Zubero et Zhou Zhou, « Melatonin as a Potent and Inducible Endogenous Antioxidant: Synthesis and Metabolism », Molecules, vol. 20, no 10, , p. 18886–18906 (ISSN 1420-3049, PMID 26501252, PMCID 6332205, DOI 10.3390/molecules201018886, lire en ligne, consulté le )
- (en) Bejarano I, Espino J, Marchena AM, Barriga C, Paredes SD, Rodríguez AB, Pariente JA, Melatonin enhances hydrogen peroxide-induced apoptosis in human promyelocytic leukaemia HL-60 cells ; Mol Cell Biochem. 2011 Jul;353(1-2):167-76. Epub 2011 Mar 23 (Résumé).
- (en) Ferreira Cda S, Maganhin CC, Simões Rdos S, Girão MJ, Baracat EC, Soares-Jr JM.Melatonin: cell death modulator ; Rev Assoc Med Bras. 2010 Nov-Dec; 56(6):715-8. (Résumé)
- (en) Cucina A, Proietti S, D'Anselmi F, Coluccia P, Dinicola S, Frati L, Bizzarri M., Evidence for a biphasic apoptotic pathway induced by melatonin in MCF-7 breast cancer cells ; J Pineal Res. 2009 Mar; 46(2):172-80. Epub 2008 Oct 29 (Résumé)
- (en) Sánchez-Barceló EJ, Cos S, Fernández R, Mediavilla MD. , Melatonin and mammary cancer: a short review, Endocr Relat Cancer, juin 2003, 10(2):153-9. (Résumé)
- (en) Manchester L. C., Poeggeler B., Alvares F. L., Ogden G. B., ReiterR. J., Melatonin immunoreactivity in the photosynthetic prokaryote Rhodospirillum rubrum : implications for an ancientantioxydant system, Cell Molec. Biol. Res., 41, 1995, p.391-395.
- Rodolphe Beaud, Hydroarylation régiosélective d’indoles pour l’accès aux motifs 3 - arylindolines : études et applications d’une nouvelle réactivité de l’indole, Institut de Chimie Moléculaire et des Matériaux d'Orsay, Université Paris-Sud, (HAL tel-01127058, présentation en ligne, lire en ligne [PDF]), p. 28.
- Jerry Vriend et Russel J. Reiter, « The Keap1-Nrf2-antioxidant response element pathway: a review of its regulation by melatonin and the proteasome », Molecular and Cellular Endocrinology, vol. 401, , p. 213–220 (ISSN 1872-8057, PMID 25528518, DOI 10.1016/j.mce.2014.12.013, lire en ligne, consulté le )
- Basile M, Romeo C, Gitto E, Spitz L, Pierro A, Eaton S, Melatonin protects from, but does not reverse, the effects of mediators of sepsis on liver bioenergetics ; Journal : Pediatric Surgery International ; 2004, p. 263-266 (Résumé)
- Katri Peuhkuri, Nora Sihvola et Riitta Korpela, « Dietary factors and fluctuating levels of melatonin », Food & Nutrition Research, vol. 56, , p. 10.3402/fnr.v56i0.17252 (ISSN 1654-6628, PMID 22826693, PMCID 3402070, DOI 10.3402/fnr.v56i0.17252, lire en ligne, consulté le )
- (en) Russel J. Reiter, L.C. Manchester et Dun-xian Tan, « Melatonin in walnuts: Influence on levels of melatonin and total antioxidant capacity of blood », Nutrition, vol. 21, no 9, , p. 920–924 (DOI 10.1016/j.nut.2005.02.005, lire en ligne, consulté le )
- (en) Rüdiger Hardeland, « Antioxidative protection by melatonin », Endocrine, vol. 27, no 2, , p. 119–130 (résumé).
- (en) Isaac Antolín, Barbara Obst, Susanne Burkhardt et Rüdiger Hardeland, « Antioxidative protection in a high-melatonin organism: the dinoflagellate Gonyaulax polyedra is rescued from lethal oxydative stress by strongly elevated, but physiologically possible concentrations of melatonin », Journal of Pineal Research, vol. 23, no 4, , p. 182–190 (résumé).
- (en) Vasin MV, Ushakov IB, Suvorov NN. « Radioprotective effectiveness of indralin in local gamma irradiation of the skin » Radiats Biol Radioecol. 1998 Jan-Feb; 38(1):42-54. (Résumé)
- (en) Vasin MV, Ushakov IB, Kovtun VIu, Komarova SN, Semenova LA, Galkin AA. « Comparative effectiveness of antioxidant melatonin and radioprotectors indralin and phenylephrine in local radiation injuries » Radiats Biol Radioecol. 2004;44(1):68-71. Article en Russe, Résumé en anglais, Source Institute of Military Medicine, Ministry of Deferense of Russian Federation, 126083 Russia
- (en) E.B. Arushanian, E.V. Beĭer, A.S. Bulgakova, « Pineal melatonin exhibits more pronounced antistressor properties than anxiolytic diazepam », Eksperimental'naia i Klinicheskaia Farmakologiia, vol. 70, no 6, , p. 9-12 (résumé).
- (en) E.B. Arushanian, E.V. Beĭer, « Immunotropic properties of pineal melatonin », Eksperimental'naia i Klinicheskaia Farmakologiia, vol. 65, no 5, , p. 73-80 (résumé).
- (en) Juan R. Calvo, C. González-Yanes et M. D. Maldonado, « The role of melatonin in the cells of the innate immunity: a review », Journal of Pineal Research, vol. 55, no 2, , p. 103–120 (DOI 10.1111/jpi.12075, lire en ligne, consulté le )
- Amy Marturana Winderl, « You Have an Autoimmune Disorder. Can You Take Melatonin? », sur HealthCentral
- (en) L.A. Brotto et B.B. Gorzalka, « Melatonin enhances sexual behavior in the male rat », Physiology & Behavior, vol. 68, no 4, , p. 483–486 (résumé).
- FA. Scheer, CJ. Morris, JI. Garcia, C. Smales, EE. Kelly, J. Marks, A. Malhotra et SA. Shea, « Repeated melatonin supplementation improves sleep in hypertensive patients treated with beta-blockers: a randomized controlled trial. », Sleep, vol. 35, no 10, , p. 1395-402 (PMID 23024438, DOI 10.5665/sleep.2122)
- K. P. Wright, B. L. Myers, S. C. Plenzler et C. L. Drake, « Acute effects of bright light and caffeine on nighttime melatonin and temperature levels in women taking and not taking oral contraceptives », Brain Research, vol. 873, no 2, , p. 310–317 (ISSN 0006-8993, PMID 10930561, DOI 10.1016/s0006-8993(00)02557-9, lire en ligne, consulté le )
- Kathleen E. West, Michael R. Jablonski, Benjamin Warfield et Kate S. Cecil, « Blue light from light-emitting diodes elicits a dose-dependent suppression of melatonin in humans », Journal of Applied Physiology (Bethesda, Md.: 1985), vol. 110, no 3, , p. 619–626 (ISSN 1522-1601, PMID 21164152, DOI 10.1152/japplphysiol.01413.2009, lire en ligne, consulté le )
- Mariana G. Figueiro et Mark S. Rea, « The Effects of Red and Blue Lights on Circadian Variations in Cortisol, Alpha Amylase, and Melatonin », International Journal of Endocrinology, vol. 2010, , p. 829351 (ISSN 1687-8337, PMID 20652045, PMCID 2905913, DOI 10.1155/2010/829351, lire en ligne, consulté le )
- Jiexiu Zhao, Ye Tian, Jinlei Nie et Jincheng Xu, « Red Light and the Sleep Quality and Endurance Performance of Chinese Female Basketball Players », Journal of Athletic Training, vol. 47, no 6, , p. 673–678 (ISSN 1062-6050, PMID 23182016, PMCID 3499892, DOI 10.4085/1062-6050-47.6.08, lire en ligne, consulté le )
- Olga Pechanova, Ludovit Paulis et Fedor Simko, « Peripheral and central effects of melatonin on blood pressure regulation », International Journal of Molecular Sciences, vol. 15, no 10, , p. 17920–17937 (ISSN 1422-0067, PMID 25299692, PMCID 4227197, DOI 10.3390/ijms151017920, lire en ligne, consulté le )
- Huanshuai Guan, Ning Kong, Run Tian et Ruomu Cao, « Melatonin increases bone mass in normal, perimenopausal, and postmenopausal osteoporotic rats via the promotion of osteogenesis », Journal of Translational Medicine, vol. 20, no 1, , p. 132 (ISSN 1479-5876, PMID 35296324, PMCID 8925213, DOI 10.1186/s12967-022-03341-7, lire en ligne, consulté le )
- Tian Li, Shuai Jiang, Chenxi Lu et Wenwen Yang, « Melatonin: Another avenue for treating osteoporosis? », Journal of Pineal Research, vol. 66, no 2, , e12548 (ISSN 1600-079X, PMID 30597617, DOI 10.1111/jpi.12548, lire en ligne, consulté le )
- Fahima Munmun et Paula A. Witt-Enderby, « Melatonin effects on bone: Implications for use as a therapy for managing bone loss », Journal of Pineal Research, vol. 71, no 1, , e12749 (ISSN 1600-079X, PMID 34085304, DOI 10.1111/jpi.12749, lire en ligne, consulté le )
- (en) Rixt F. Riemersma-van der Lek, Dick F. Swaab, Jos Twisk, Elly M. Hol, Witte J. G. Hoogendijk, Eus J. W. Van Someren, « 'Effect of bright light and melatonin on cognitive and non cognitive function of elderly residents of group care facilities. A randomized controlled trial », Journal of the American Medical Association (JAMA), vol. 229, no 22, , p. 2642-2655 (résumé).
- Cité dans un « Article de Julie Luong intitulé Lumière et mélatonine contre la maladie d'Alzheimer »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (15 octobre 2008).
- José Carlos Pereira, Márcia Pradella Hallinan et Rosana Cardoso Alves, « Secondary to excessive melatonin synthesis, the consumption of tryptophan from outside the blood-brain barrier and melatonin over-signaling in the pars tuberalis may be central to the pathophysiology of winter depression », Medical Hypotheses, vol. 98, , p. 69–75 (ISSN 1532-2777, PMID 28012610, DOI 10.1016/j.mehy.2016.11.020, lire en ligne, consulté le )
- Maria E. J. Bouwmans, Elisabeth H. Bos, Sanne H. Booij et Martijn van Faassen, « Intra- and inter-individual variability of longitudinal daytime melatonin secretion patterns in depressed and non-depressed individuals », Chronobiology International, vol. 32, no 3, , p. 441–446 (ISSN 1525-6073, PMID 25347155, DOI 10.3109/07420528.2014.973114, lire en ligne, consulté le )
- Médicament développé par les laboratoires Servier et Novartis qui est vendu sous le nom de Valdoxan.
- Barbara Nussbaumer-Streit, Amy Greenblatt, Angela Kaminski-Hartenthaler et Megan G. Van Noord, « Melatonin and agomelatine for preventing seasonal affective disorder », The Cochrane Database of Systematic Reviews, vol. 6, no 6, , p. CD011271 (ISSN 1469-493X, PMID 31206585, PMCID 6578031, DOI 10.1002/14651858.CD011271.pub3, lire en ligne, consulté le )
- (en) Maria D. Maldonado, Russel J. Reiter et Maria A. Pérez-San-Gregorio, « Melatonin as a potential therapeutic agent in psychiatric illness », Human Psychopharmacology: Clinical and Experimental, vol. 24, no 5, , p. 391–400 (ISSN 1099-1077, DOI 10.1002/hup.1032, lire en ligne, consulté le )
- George Anderson et Michael Maes, « Melatonin: an overlooked factor in schizophrenia and in the inhibition of anti-psychotic side effects », Metabolic Brain Disease, vol. 27, no 2, , p. 113–119 (ISSN 1573-7365, PMID 22527998, DOI 10.1007/s11011-012-9307-9, lire en ligne, consulté le )
- Yunho Jin, Jeonghyun Choi, Seunghoon Lee et Jong Won Kim, « Pathogenetical and Neurophysiological Features of Patients with Autism Spectrum Disorder: Phenomena and Diagnoses », Journal of Clinical Medicine, vol. 8, no 10, , p. 1588 (ISSN 2077-0383, PMID 31581672, PMCID 6832208, DOI 10.3390/jcm8101588, lire en ligne, consulté le )
- M. L. Rao, B. Müller-Oerlinghausen, A. Mackert et B. Strebel, « Blood serotonin, serum melatonin and light therapy in healthy subjects and in patients with nonseasonal depression », Acta Psychiatrica Scandinavica, vol. 86, no 2, , p. 127–132 (ISSN 0001-690X, PMID 1529735, DOI 10.1111/j.1600-0447.1992.tb03240.x, lire en ligne, consulté le )
- A. Shechter, P. Lespérance, NM. Ng Ying Kin et DB. Boivin, « Pilot Investigation of the Circadian Plasma Melatonin Rhythm across the Menstrual Cycle in a Small Group of Women with Premenstrual Dysphoric Disorder. », PLoS One, vol. 7, no 12, , e51929 (PMID 23284821, DOI 10.1371/journal.pone.0051929, lire en ligne)
- (en)Yi Zhanga, « Melatonin inhibits the caspase-1/cytochrome c/caspase-3 cell death pathway, inhibits MT1 receptor loss and delays disease progression in a mouse model of amyotrophic lateral sclerosis », Neurobiology of Disease, vol. 55, 2013, Pages 26–35 résumé en ligne
- (en) Vijendra Ramlall, Jason Zucker et Nicholas Tatonetti, « Melatonin is significantly associated with survival of intubated COVID-19 patients », MedRxiv (prépublication), Health Informatics, (PMID 33083812, PMCID PMC7574268, DOI 10.1101/2020.10.15.20213546, lire en ligne, consulté le )
- (en) Yadi Zhou, Yuan Hou, Jiayu Shen et Reena Mehra, « A network medicine approach to investigation and population-based validation of disease manifestations and drug repurposing for COVID-19 », PLOS Biology, vol. 18, no 11, , e3000970 (ISSN 1545-7885, DOI 10.1371/journal.pbio.3000970, lire en ligne, consulté le )
- Luc Ruidant, « Covid-19 : la piste prometteuse de la mélatonine », sur Site-UpdateSpecialiste-FR, (consulté le )
- Ye-min Wang, Bao-zhe Jin, Fang Ai et Chang-hong Duan, « The efficacy and safety of melatonin in concurrent chemotherapy or radiotherapy for solid tumors: a meta-analysis of randomized controlled trials », Cancer Chemotherapy and Pharmacology, vol. 69, no 5, , p. 1213–1220 (ISSN 1432-0843, PMID 22271210, DOI 10.1007/s00280-012-1828-8, lire en ligne, consulté le )
- Paolo Lissoni, Franco Rovelli, Fernando Brivio, Giusy Messina, Arianna Lissoni, Sonja Pensato et Giuseppe Di Fede, « Five Year-Survival with High-Dose Melatonin and Other Antitumor Pineal Hormones in Advanced Cancer Patients Eligible for the Only Palliative Therapy », Research Journal of Oncology, vol. 2, no 1: 2, (lire en ligne [PDF])
- Paolo Lissoni, Giorgio Porro1, AlejandraMonzon1, Arianna Lissoni, et al. (2021), A Randomized Study of High-Dose Pineal Hormone Melatonin Alone Versus High-Dose Melatonin Plus Low-Dose Angiotensin-(1-7) in Untreatable Advanced Cancer Patients. Journal of Oncology Research Review & Reports. SRC/JONRR-130
- (en) Paolo Lissoni, Giorgio Porro, Carla Galli et Rosalia Codogni, « A Preliminary Phase-2 Study with very High-Dose of Melatonin (1000 mg/day) in Untreatable Advanced Cancer Patients Already Progression on Previous Palliative Therapy with High-Dose Melatonin », Trends in Oncology, vol. 2, no 2, , p. 1–5 (ISSN 2717-5278, DOI 10.37155/2717-5278-0202-1, lire en ligne, consulté le )
- Ping-Tao Tseng, Chun-Pai Yang, Kuan-Pin Su et Tien-Yu Chen, « The association between melatonin and episodic migraine: A pilot network meta-analysis of randomized controlled trials to compare the prophylactic effects with exogenous melatonin supplementation and pharmacotherapy », Journal of Pineal Research, vol. 69, no 2, , e12663 (ISSN 1600-079X, PMID 32347977, DOI 10.1111/jpi.12663, lire en ligne, consulté le )
- Alfonso Mansilla-Roselló, Jorge Hernández-Magdalena, Mireia Domínguez-Bastante et Carmen Olmedo-Martín, « A phase II, single-center, double-blind, randomized placebo-controlled trial to explore the efficacy and safety of intravenous melatonin in surgical patients with severe sepsis admitted to the intensive care unit », Journal of Pineal Research, , e12845 (ISSN 1600-079X, PMID 36428216, DOI 10.1111/jpi.12845, lire en ligne, consulté le )
- Leticia M. Nogueira, Joshua N. Sampson, Lisa W. Chu et Kai Yu, « Individual Variations in Serum Melatonin Levels through Time: Implications for Epidemiologic Studies », PLoS ONE, vol. 8, no 12, , e83208 (ISSN 1932-6203, PMID 24376664, PMCID 3871612, DOI 10.1371/journal.pone.0083208, lire en ligne, consulté le )
- (en) Sack RL, Auckley D, Auger RR. et al. « Circadian rhythm sleep disorders: part I, basic principles, shift work and jet lag disorders. An American Academy of Sleep Medicine review » Sleep. 2007;30:1460–1483
- (en) Buscemi N, Vandermeer B, Hooton N. et al. « The efficacy and safety of exogenous melatonin for primary sleep disorders. A meta-analysis » J Gen Intern Med. 2005;20:1151–1158
- [1], Agence européenne des médicaments.
- Journal officiel de la République française no 0082 du 7 avril 2009 page 6068, Arrêté du 26 mars 2009 portant classement sur les listes des substances vénéneuses, NOR:SASP0907274A.
- Journal officiel de la République française no 0231 du 5 octobre 2011 page 16842, texte no 21, Arrêté du 23 septembre 2011 portant classement sur les listes des substances vénéneuses, NOR: ETSP1125961A.
- Damien Mascret, « La mélatonine encore en vente libre malgré l'interdiction », Le Figaro - Santé, (lire en ligne)
- « Avis HAS Circadin », sur HAS, (consulté le )
- [2], Agence française de sécurité sanitaire des produits de santé.
- [3], Agence française de sécurité sanitaire des produits de santé.
- « Mélatonine : substance active à effet thérapeutique », sur VIDAL (consulté le )
- µg : microgrammes.
- (en) « Small melatonin dose may be all that's needed for better sleep », sur MIT News | Massachusetts Institute of Technology (consulté le )
- (en) Zhdanova I, Wurtman R, Regan M, Taylor J, Shi J, Leclair O. « Melatonin treatment for age-related insomnia » J Clin Endocrinol Metab. 2001;86(10) p. 4727-30
- (en) Lewy AJ, Emens JS, Sack RL, Hasler BP, Bernert RA. « Low, but not high, doses of melatonin entrained a free-running blind person with a long circadian period » Chronobiol Int. 2002;19, 3, p. 649-58,
- (en) Wolkove N, Elkholy O, Baltzan M, Palayew M, « Sleep and aging : 2. Management of sleep disorders in older people » CMAJ : Canadian Medical Association Journal - Journal de l'Association médicale canadienne 2007, volume 176, no 10, p. 1449-54
- (en) McGechan A, Wellington K. « Ramelteon » CNS Drugs 2005;19:1057-65; discussion 1066-7.
- (en) Pilar Alarma-Estrany, Ana Guzman-Aranguez, Fernando Huete, Assumpta Peral, Robert Plourde Jr, Teresa Pelaez, Benjamin Yerxa et Jesús Pintor, « Design of novel melatonin analogs for the reduction of intraocular pressure in normotensive rabbits », The Journal of Pharmacology and Experimental Therapeutics, vol. 337, no 3, , p. 703-709 (résumé).
- Pintor J, Peláez T, Hoyle CH, Peral A. « Ocular hypotensive effects of melatonin receptor agonists in the rabbit: further evidence for an MT3 receptor » Br J Pharmacol. 2003 Mar;138(5):831-6. (Résumé)
- (en) Andrés-Guerrero V, Alarma-Estrany P, Molina-Martínez IT, Peral A, Herrero-Vanrell R, Pintor « Ophthalmic formulations of the intraocular hypotensive melatonin agent 5-MCA-NAT » J Exp Eye Res. 2009 Mar; 88(3):504-11. Epub 2008 Nov 14. (Résumé)
- « Les secrets de l'« hormone du sommeil » révélés par des chercheurs. Une découverte conduit au développement d’un nouveau traitement prometteur pour l’insomnie » communiqué de presse, centre Universitaire de santé McGill, 14 décembre 2011
- (en) Schwertner A, Conceição dos Santos CC, Dalferth Costa G et al. « Efficacy of melatonin in the treatment of endometriosis: A phase II, randomized, double-blind, placebo-controlled trial » Pain 2013;154:874-81.
- Maria Consuelo Mura, Sebastiano Luridiana, Federico Farci et Maria Veronica Di Stefano, « Melatonin treatment in winter and spring and reproductive recovery in Sarda breed sheep », Animal Reproduction Science, vol. 185, , p. 104–108 (ISSN 1873-2232, PMID 28823418, DOI 10.1016/j.anireprosci.2017.08.009, lire en ligne, consulté le )
- Alfred J. Lewy, Jonathan S. Emens, Bryan J. Lefler et Krista Yuhas, « Melatonin entrains free-running blind people according to a physiological dose-response curve », Chronobiology International, vol. 22, no 6, , p. 1093–1106 (ISSN 0742-0528, PMID 16393710, DOI 10.1080/07420520500398064, lire en ligne, consulté le )
- ANSES (2018) L’Anses recommande à certaines populations d’éviter la consommation de compléments alimentaires contenant de la mélatonine Actualité du 11/04/2018
- Zoe Menczel Schrire, Craig L. Phillips, Julia L. Chapman et Shantel L. Duffy, « Safety of higher doses of melatonin in adults: A systematic review and meta-analysis », Journal of Pineal Research, vol. 72, no 2, , e12782 (ISSN 1600-079X, PMID 34923676, DOI 10.1111/jpi.12782, lire en ligne, consulté le )
Bibliographie
- (en) Eva Berger, Jan-Dirk Fauteck, Erwin-Josef Speckmann, « Melatonin receptors in rat hippocampus: molecular and functional investigations », Hippocampus, New York, Wiley-Liss, vol. 12, no 2, , p. 165-173 (ISSN 1050-9631, OCLC 5154408590)
- (en) Jan-Dirk Fauteck et Andrea Eder (trad. de l'allemand), The Magic of Melatonin : how this amazing hormone will help you sleep, reduce pain, relieve anxiety, slow aging, and much more [« Melatonin : das Geheimnis eines wunderbaren Hormons »], New York, Skyhorse Publishing, , xvii, 180 (ISBN 9781510747920, OCLC 1130689722)
Voir aussi
Articles connexes
Liens externes
- Ressources relatives à la santé :
<footer>source wp:Mélatonine</footer>


